
 | |
|
|
Главная » Книги и журналы 1 2 3 4 5 6 7 8 ... 55 использовались коэффициенты диффузии никеля в медь и меди в никель, лолутен'ные при помощи рентгенострукгурного Метода. При 400 °С диффузия относительно невелика, ио она значительно повышается при 500 и особенно 600 С. Например, через 500 ч диффузионного отжига при 400 °С концентрация никеля в -меди на расстоянии 0,01 мм от траницы составляет менее 0,005%, а при 500 и 600 С - соответстветю 13,5 и 36,5%. Так как общая проводимость биметаллического провода в основном определяется проводимостью медного сердечника, то диффузия меди в никель незначительно увеличивает электрическое сопротивле-
OMS D.0W 0.015 Глубина диффузии Ni6 Са , мм 0.020 Рис. 1-17. Распределение никеля в меди после выдержки биметаллической проволоки Си-N1 при 500 °С. ние провода (примерно 6-.8% общего увеличения удельного сопротивления). Поэтому при 400-600 °С для упрощения расчетов целесообразно учитывать только диффузию никеля в медь, а затем полученный прирост сопротивления увеличивать в 1,06-1,08 раза. Взаимная диффузия меди и никеля иллюстрируется микрофотографиями шлифов биметаллической проволоки Си - Ni после ее пребывания при 400-бОО^С (рис. 1 18-1-19). Эти микрофотографии показывают, что диффузия начинает проявляться отчетливо после 1 200 ч пребывания проволоки при 400 С. При 500 °С уже после 72 ч па границе меди и никеля образуется переходная зона с мелкокристаллической структурой, которая все более отчетливо проявляется при повышении длительности и температуры эксплуатации проводов. В случае применения методики расчета увеличения сопротивления к тримета.плической проволоке (Си - Ag - А1, Си - Ni -А1 и т. п.) определение этого увеличения значительно усложняется. Распределение концентрации диффупдирующИх металлов во времени будет выражаться сложными формулами, учитывающими диффузию металла прослойки в сердечник и оболочку и взаимную диффузию металлов сердечника и оболочки через прослойку. В этом случае, а также при возможном в будущем применении прослоек из неорганических веществ целесообразно вводить в формулы для определения концентраций диффундирующих элементов поправочные коэффициенты, определяемые экспериментально. Предложенная методика расчета увеличения сопротивления биметаллических проводов может применяться не только для имеющих- 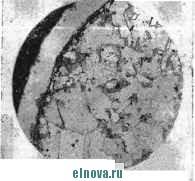 Рис. 1-18. Проволока Си-Ni (500 °С; 72 ч). ся конструкций токопроводящих жил, но и при разработке новых конструкций. Определив расчетным путем распределение концентрации диффундирующих металлов сердечника и оболочки, можно заранее рассчитать увеличение сопротивления проводов для тех или иных температурных условий. В ряде случаев для нагревостойких обмоточных проводов применяется незащищенная медная проволока или медная проволока с защитными металлическими покрытиями, нанесенными электрохимическим способом. Так как гальванические покрытия на проволоке обычно имеют небольшую толщину (несколько микрометров), то влиянием диффузии на увеличение сопротивления можно в этом случае пренебречь и учитывать только окисление поверхности проволоки. Окисление поверхности проводника вызывает увеличение электрического сопротивления провода и приводит к снижению эластичности, а иногда и отслаиванию изоляционного покрытия. Между скоростью и временем окисления существуют различные соотношения. Так как процесс окисления относится к поверхностным реакциям, подчиняющимся уравнению Аррениуса, то скорость окисления экспоненциально увеличивается с увеличением тем'пературы. Окисление меди, являющейся основным проводниковым материалом для обмоточных проводов, в диапазоне 300-800 °С протекает во времени по параболической зависимости. Так как медь образует с кислородом два окисных соединения, то наиболее богатое кислородом соединение СиО (окись меди) располагается у поверхности окис-ная пленка - газ, а между металлом и окисью меди находится за-  Рис. 1-19. Прово.10ка Си-Ni (600 °С; 120 ч). кись меди СигО. Величина отношения толщин слоев закиси и окиси меди не зависит от времени окисления, ио зависит от температуры. При температуре около 600 °С окисная пленка содержит 50% СиО и 50% СигО; прн более высокой температуре в окисной пленке увеличивается содержание закиси меди. Последнее объясняется меньшей термодинамической устойчивостью окиси -меди по сравнению с закисью. Образующаяся окНсная пленка легко отслаивается от подложки, что приводит к необходимости защиты токопроводящих жил обмоточных проводов от окисления при высоких темлературах. Если электрическое сопротивление медного провода в исходном состоянии обозначить R, то после пребывания провода при повышенных температурах оно увеличится до R за счет окисления поверхности проволоки и уменьшения ее фактического сечения: (rf-2e )= (1-14) где (i -диаметр жилы; 6м-толщина слоя окислившегося металла. Зная закономерности изменения толщины окислившегося слоя во времени, можно рассчитать увеличение электрического сопротивления провода в процессе его эксплуатации. .Представляется наиболее целесообразным получить эмпирические соотношения между тол-Щ.ИНОЙ слоя окислившегося металла и Временем эксплуатации проводов при данной температуре, а затем по приведенной выше формуле определить отношение R/R. Это справедливо не только для медных .проводников, но и для проводников, имеющих гальванические защитные покрытия, так как вследствие незначительной толщины покрытия процессы взаимной диффузии меди и металла покрытия до момента начала окисления не успевают развиться. При циклических температурных нагрузках толщина слоя окислившегося металла зависит от времени линейно вследствие интенсив-пого растрескивания образующейся окисной пленки. В этом случае для расчета увеличения электрического сопротивления обмоточных проводов можно применять следующую формулу: Если провода непрерывно работают пр-и повышенных температурах -или количество циклов изменений температуры невелико, растрескивание окисной пленки и тем более ее осыпание замедляются. В результате рост толщины слоя окислившегося металла с течением времени будет иметь вид параболической зависимости, характерной для меди, и отношение RlR определится следующим уравнением: (1-16) rf -2(/fenX - 6) В выражениях (1-15) ,и (1-16) и fen - коэффициенты скорости роста окисной пленки во време;ни т, зависящие от материала жилы, типа и толщины металлического защитного покрытия и' изоляции, а также от режима эксплуатации проводов; коэффрщиент b характеризует время, в теч ние которого окисление протекает медленно и практически не пргиводит к увеличению электрического сопротивления провода. Коэффициенты k, kn к b могут быть определены для любого вида обмоточных проводов. В том случае, если .изоляция провода не растрескизается, увеличение электрического сопротивления при повышенных температурах необходимо рассчитывать по формуле (1-16). Такая закономерность характерна для проводов марки ПОЖ при температуре до 400 С, в которых для пропитки стекловолокна применяются оргапосиликат-пые нагревостойкие пропитывающие составы, обладающие высокими цементирующими свойствами, предотвра.щающими растрескивание окисной пленки. Как только полимер начинает растрескиваться, дальнейший рост слоя окислившегося металла происходит по линейному закону. Если растрескавшаяся окисная пленка начинает отслаиваться, то с определенного момента времени (для .проводов марки ПОЖ при 600 С через 120 ч) окисление ускоряется. Поэтому при эксплуатации проводов марки ПОЖ при 600 °С свыше 120 ч отношение RlR должно определяться по другой форм;уле: R { d (1-17) [12Cfe -f fe, (x-120)] Г где коэффициент km определяется экспериментально. Глввавторая ЭМАЛЬЛАКИ Общие сведения об эмальлаках Эмальлаками называются жидкие составы, которые применяются для изготовления обмоточных проводов с эмалевой изоляцией, а также для изолирования отдельных проволок высокочастотных обмоточных прово-!1,ов, монтажных проводов и т. п. Обычно эмальлаки состоят из двух основных частей: пленкообразующих веществ и растворителя. В последнее время в Советском Союзе н.а отдельных заводах начинает внедряться новая технология эмалирования, которая предусматривает применение полиэфирных лаков без растворителя. В зависимости от природы пленкообразующих веществ эмальлаки можно разделить на две группы: эмальлаки на масляно-смоляной основе (растворитель- керосин) и синтетические эмальлаки. Эмаль-пленки первых лаков по своим физико-механическим свойствам заметно уступают пленкам на синтетических лаках, и поэтому в последнее время масляно-смо-ляные лаки успешно заменяются различными синтетическими лаками. В рецептурах некоторых синтетических эмальлаков, помимо основного пленкообразующего вещества, характеризующего природу и тип эмальлака, предусматривается введение резольных смол, повышающих твердость и механическую прочность эмалевых пленок (поливинилацеталевые лаки вииифлекс и металвин, полиамидно-резольные лаки). В других синтетических эмальлаках пленкообразующая часть состоит из одного вещества, образующего пленку (полиуретановые, полиэфирные и другие лаки). Синтетические пленкообразующие материалы требуют по сравнению с масляно-смоля-ными эмальлаками химически более активных растворителей. Состав последних определяется природой пленкообразующей части лаков, что подробно освещено ниже. 2-1. ОСНОВНЫЕ СВЕДЕНИЯ О ПЛЕНКООБРАЗУЮЩИХ ВЕЩЕСТВАХ К числу пленкообразующих веществ относятся соединения, которые способны при окислении или нагревании образовывать пленки. Большинство пленкообразователей - либо высокомолекулярные соединения, либо превращаются в таковые в процессе образования пленки. Этн вещества имеют самое разнообразное химическое строение. В кабельной технике широкое применение имеют различные синтетические смолы [производные поливинилового спирта (ацетали), полиэфиры и др.]. В некотором количестве для изготовления эмальлаков пока применяются также растительные масла. в зависимости от характера процесса образования пленки пленкообразующие вещества могут быть разделены на следующие группы: а) Термопластичные пленкообразующие вещества. К таким пленкообразователям относятся полиамидные, поливинилхлоридные и некоторые естественные смолы. б) Термореактивные пленкообразующие вещес?-ва. При нагревании пленки этих веществ не плавятся и становятся более хрупкими (бакелитовые, эпоксидные смолы и др.). в) Самоокисляюшиеся пленкообразующие вещества, которые способны окисляться на воздухе без нагревания (высыхающие растительные масла и т. п.). г) Пленкообразующие вещества, которые образуют пленку при воз,действии катализаторов (некоторые виды полиуретановых смол и т. п.). Основными факторами, которые влияют на процесс пленкообразования, являются: 1) качество основного пленкообразующего вещества, степень его химической и физической однородности; 2) состав летучего растворителя, его химическое сродство с пленкообразующим веществом, летучесть и прочие физико-химические свойства; 3) состав и количество пластификаторов и других компонентов, входящих в лак и определяющих свойства пленки; 4) физико-химические характеристики лака (концентрация, вязкость и т. п.), продолжительность хранения лака и условия пленкообразования (температура и насыщенность парами растворителя окружающей среды, скорость движения и гигроскопичность воздуха и т. п.). Добавление в лак пигментов оказывает влияние на скорость испарения растворителя: крупнодисперсные пигменты обычно ускоряют, а мелкодисперсные замедляют испарение. При образовании пленки часто имеет место ее так называемая усадка, которая является результатом того, что при испарении растворителя расстояние между макромолекулами сокращается и начинают действовать силы, притягивающие эти молекулы одну к другой. Усадка тем меньше, чем меньше содержание растворителя в нанесенном лаке. Чем выше степень полимеризации, тем больше усадка. В производстве эмалированных проводов повышенная величина усадки несколько снижает эла- стичность эмалевой изоляции. Повышение степени полимеризации (пересушенная змаль) всегда сопровождается снижением эластичности эмалевой пленки. Значительная усадка вследствие испарения растворителя и части пластификаторов наблюдается у пленок из эфиров целлюлозы, вследствие чего эластичность изоляции проводов, обмотанных такими пленками, с течением времени заметно уменьшается. В производстве эмалированных проводов существенное значение имеет также величина сил адгезии эмалевой пленки к металлу. На величину последней влияет ориентация полярных молекул при нанесении жидкого лака на металл, которые при образовании твердой пленки остаются вблизи поверхности металла. Можно полагать, что чем больше содержание полярных молекул в лаке и чем выше степень полярности их, а также чем резче выражена способность их к указанной ориентации, тем больше адгезия пленки к металлу. В связи с этим лаки с большими молекулами полимеров должны давать пленки с меньшей адгезией, чем лаки с молекулами меньших размеров, так как последние обладают большей подвижностью и способностью ориентироваться и, следовательно, более прочно приставать к металлической поверхности. 2-2. ОСНОВНЫЕ СВЕДЕНИЯ О РАСТВОРИТЕЛЯХ Растворителями называются органические летучие жидкости, которые способны растворять такие вещества, как жиры, натуральные и синтетические смолы, воски, асфальты, каучуки и др. Растворы этих веществ можно получать различных концентраций в зависимости от растворяющей способности растворителя и растворимости того или иного вещества. Жидкости, которые применяются для снижения вязкости (разбавления) готовых растворов, называются разбавителями. Нелетучие специальные жидкости, которые остаются в пленке после ее высыхания и предназначены для увеличения гибкости пленки, называются пластификаторами Из многих теорий, трактующих процесс растворения, большое распространение имеет теория Лэнгмюра-Гиль-дебранта, согласно которой растворение вещества зави- сит от наличия в растворяемом веществе и растворителе полярных или неполярных групп. При взаимодействии диполей полярных веществ (молекулярная когезия) происходит молекулярная ассоциация. Если встречаются полярные и неполярные молекулы, образование молекулярной ассоциации затрудняется. В этом случае возможно отталкивание молекул одной группы от молекул других групп и растворение или смешение веществ не происходит. Таким же образом можно представить и про цесс растворения твердых веществ, который будет активно проходить в полярных растворителях, если растворяемое вещество будет полярным, и наоборот. Различают истинные (кристаллоидные) и коллоидные растворы. Строгое разграничение обоих типов растворов затруднительно, так как растворяемые вещества с очень большой молекулярной массой образуют растворы, которые находятся в граничной области между кри-сталлоидными и коллоидными растворами. iB истинных растворах растворитель проникает глубоко в растворяемое вещество и разделяет его на отдельные молекулы. Такие растворы представляют собой гомогенную смесь, в которой молекулы растворителя и растворимого вещества находятся в свободном состоянии. Если растворитель соприкасается с коллоидообра-зующим веществом, то в последнем наступает разрыхление структуры, которое прежде всего проявляется в набухании внешних слоев. Большие молекулы коллоидов или их агрегаты связывают много молекул растворителя, и поэтому полное разделение молекул растворяемого вещества и растворителя невозможно. Коллоидные растворы отличаются от истинных еще и тем, что для них не существует определенного для той или иной температуры предела растворимости и поэтому растворяющая способность растворителей в этом случае определяется несколько другими методами, чем у истинных растворов. Растворители оказывают значительное влияние на качество готовой пленки. Например, быстро испаряющийся растворитель может нарушить целостность образующейся пленки; наличие в растворителе трудно испаряющихся частей оказывает пластифицирующее действие на пленку. Активность растворителя определяется скоростью растворения пленкообразователя, осаждением его из раствора при понижении температуры (чем ниже температура осаждения, тем- активнее растворитель), сравнением вязкости растворов при одинаковой концентрации пленкообразователя (чем меньше вязкость, тем активнее растворитель) и осаждением пленкообразователя из раствора при добавлении разбавителя. Отношение объема разбавителя к объему растворителя может служить мерой растворяющей способности растворителя. Для ароматических углеводородов это отношение больше, чем для алифатических. Жидкости с малой молекулярной массой обладают большей растворяющей способностью, чем жидкости с большой молекулярной массой. Растворители обладают высокой упругостью пара. Последняя обычно характеризуется температурой кипения растворителя, т. е. той температурой, при которой упругость паров становится равной атмосферному давлению. По температуре кипения растворители можно классифицировать следующим образом: 1) низкокипящие растворители с температурой кипения 30-70 °С; 2) сред-некипящие растворители с температурой кипения 70- 110°С; 3) высококипящие растворители с температурой кипения 110-170 °С. Растворители, температура кипения которых находится в пределах 200-300 °С, неудобны для применения вследствие весьма медленного их улетучивания. Жидкости, температура кипения которых выше 300°С, обычно относятся к пластификаторам. На практике летучесть растворителей часто характеризуется временем испарения капли растворителя, нанесенной на фильтровальную бумагу, причем за единицу летучести принимается время испарения серного эфира (табл. 2-1). Большинство летучих растворителей являются весьма горючими веществами, пары которых в смеси с воздухом могут образовывать вспыхивающие и даже гремучие смеси. Огнеопасность растворителей, которые могут вызвать взрыв, помимо объемной концентрации паров (%), в известной степени характеризует также температура кипения, вспышки (воспламенения) паров и самовоспламенения жидкости (табл. 2-1). Все летучие растворители в той или иной степени токсичны. Более опасными в этом отношении являются легколетучие растворители, так как обычно они содержатся в воздухе в большем количестве, чем высококи- Та б ли Ц-Э 2-! Физические свойства растворителей
1 2 3 4 5 6 7 8 ... 55 |